近期受全球疫情爆发影响,国外对口罩等防疫物资的需求量大增,口罩出口成了大家关注的焦点。
那么,口罩出口,需要什么资质?需要提供哪些资料信息?详情请见:关于口罩出口需注意!
除了上文所述,口罩出口还需要注意什么?
出口必读
首先了解下医疗器械的相关资质:
l 从事第一类医疗器械生产的,由生产企业向所在地设区的市级人民政府食品药品监督管理部门办理备案;
l 从事第二类、三类医疗器械生产的,生产企业向所在地省自治区直辖市人民政府食品药品监督管理部门办理生产许可;
l 经营第一类医疗器械不需许可和备案;
l 经营第二类医疗器械实行备案管理,办理医疗器械经营备案凭证;
l 经营第三类医疗器械实行许可管理,办理医疗器械经营许可证。
具体可查看《医疗器械监督管理条例》《医疗器械生产监督管理办法》和《医疗器械经营监督管理办法》
医用口罩属于二类医疗器械,应在经营范围内,取得医疗器械注册证/医疗器械生产许可/医疗器械经营备案资质,有进出口经营权。
用于销售出口可采用一般贸易方式申报,建议上传以下申报清单。
A
非医用口罩(不属于医疗器械范围)出口报关时,注明“非医用”:
1.发票、装箱单
2.检测报告(CMA CNAS)及合格证(厂检单)
3.海关所需其他补充说明的文件
B
医用口罩出口报关时,备注栏录入“防疫物资和证书编号”
1.发票、装箱单
2.《医疗器械经营备案凭证》
3. 检测报告(CMA、CNAS)及合格证(厂检单)
4. 海关所需其他补充说明的文件
重要提醒
(医用口罩等医疗器械)
1. 生产企业出口医疗器械的,应先办理产品出口备案、出口销售证明(网址见文末),应当建立并保存出口产品档案。内容包括已办理的《医疗器械产品出口销售证明》和《医疗器械出口备案表》、购货合同、质量要求、检验报告、合格证明、包装、标签式样、报关单等,以保证产品出口过程的可追溯。
2. 生产出口医疗器械的,应当保证其生产的医疗器械符合进口国(地区)的要求,并将产品信息向所在地设区的市级食品药品监督管理部门备案。
3. 生产企业接受境外企业委托生产在境外上市销售的医疗器械的,应当取得医疗器械质量管理体系第三方认证或者同类产品境内生产许可或者备案。
4. 不合格三无产品无论是何种贸易方式都无法正常出口。
5. 申报时注明是防疫物资,出口时按查验指令通关,根据海关现场实施查验的要求提供质量检测报告(或现场抽样送检),且能提供三证齐全(医疗器械注册证、医疗器械生产许可证、 医疗器械经营许可证 )。
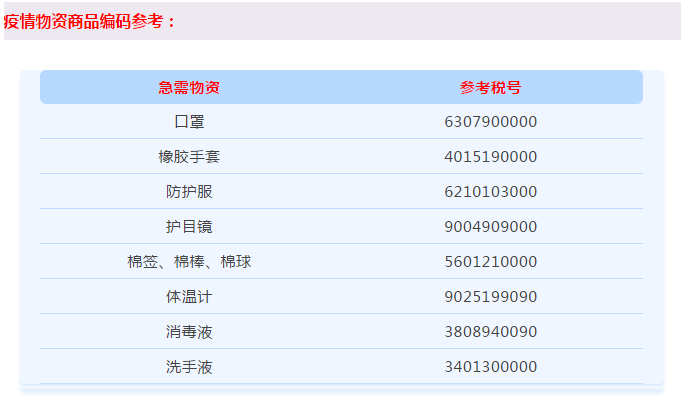
口罩出口的各国标准及认证要求
以下为补充的主要地区及国家口罩标准和认证要求
个人邮寄
1. 由于每个国家关于进口口罩的要求不同,建议大家出口前务必咨询当地的代理公司或者接收方,避免物资被扣或者被退回;
2. 自用口罩的出口及快递,数量一定要在合理范围,如果数量巨大也有可能被国外海关扣押;
3. 目前航空海运运力还没有完全恢复,运输时间都相对较长,建议在发货后留意单号更新,同时耐心等待,只要没有违规问题,一般不会被扣押或者退回。
中国出口(公司行为)
用于销售
需要经营范围内有医疗器械经营许可证的、进出口权的才能出口。
用于赠送或代为采购
作为赠送的,或者代关联公司(兄弟公司,母子公司)采购的,要提供采购厂家或公司国内生产厂家的相关资质证明文件,与我们进口时要国外提供三证(营业执照、产品医疗器械备案证明、厂家检查报告)一个道理。
韩国
口罩标准及认证要求
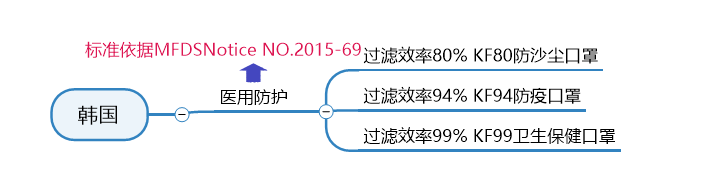
韩国的口罩标准KF (Korean filter) 系列,是由韩国的食品药品管理部门 (Ministry of Food and Drug Safety,MFDS) 发布的韩国主流口罩标准 (Regulations on the Approval,Notification,and Evaluation of Quasi-Drugs) 。
日本
口罩标准及认证要求
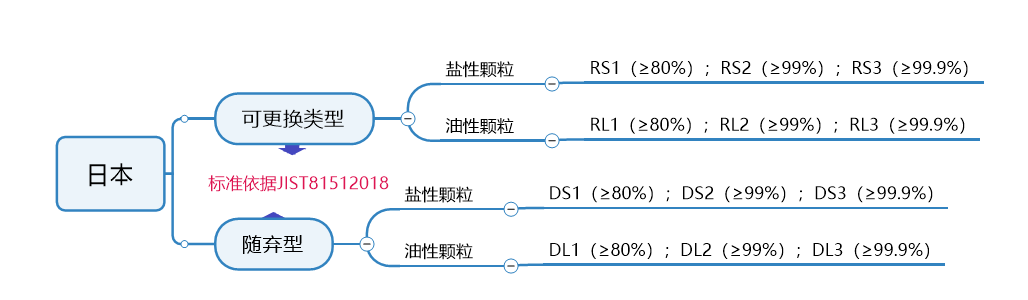
日本JIST81512018标准是呼吸保护装置的标准,也是日本厚生劳动省 (MHLW) 验证标准,出口日本需要做此认证。
欧盟
口罩标准及认证要求
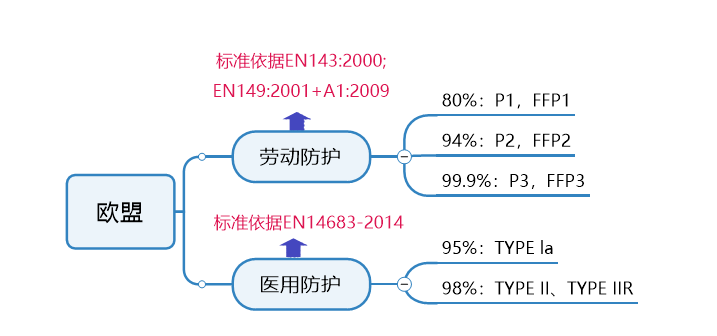
一般防护口罩认证要求:
个人防护口罩的欧洲标准是EN149及EN143,防护口罩需要满足欧盟个人防护设备指令(PPE)的要求,审核企业质量管理体系和CE技术文档,审核通过后可获得PPE法规的CE证书。
医用防护口罩认证要求:
医用口罩对应的欧洲标准是EN14683,按照医疗器械法规2017/745/EU的要求,口罩产品可以按照一类器械进行管理。依据产品是无菌或非无菌状态提供,认证模式有所差别。
美国
口罩标准及认证要求
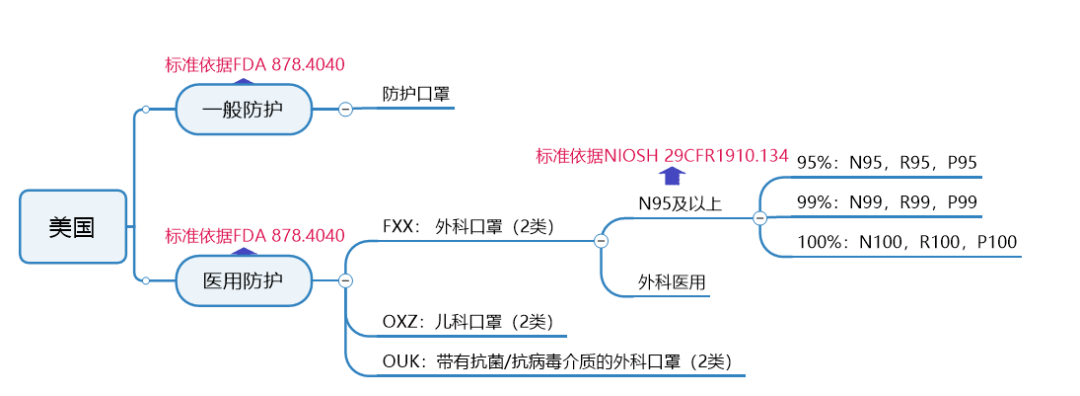
美国一般防护口罩认证要求:
按照美国FDA医疗I类做认证,流程为:
①填写申请表格,信息确认;
②获取PIN码,交付年费;
③下发注册号;
④产品出口。
医用外科口罩认证要求:
按照美国FDA医疗II类做认证,流程为:
①产品测试(性能测试、生物学测试);
②准备510K文件,提交FDA评审;
③FDA发510K批准信;
④完成工厂注册和机器列名;
⑤产品出口。
医用N95及以上9种口罩认证要求:
按照NIOSH认证标准,企业需寄送样品至NIOSH实验室实施测试,同时提交技术性资料至NIOSH文审,文审和测试都通过后,NIOSH核发批文。
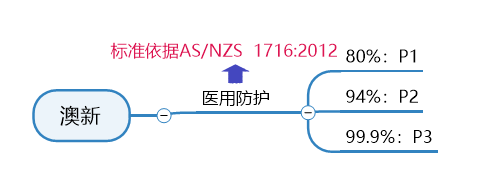
澳大利亚&新西兰
口罩标准及认证要求
AS/NZS 1716:2012是澳大利亚和新西兰的呼吸保护装置标准,相关产品制造流程和测试必须符合本规范。
注:以上内容仅供参考,请以实际业务为准!


 0
0 评论
评论




















